恒瑞首个自免创新药夫那奇珠单抗获批上市,用于银屑病治疗
近日,恒瑞医药子公司苏州盛迪亚生物医药有限公司收到**药品监督管理局核准签发的《药品注册证书》,批准公司自主研发的1类新药夫那奇珠单抗注射液(安达静®)上市,用于**适合接受系统**或光疗的中重度斑块状银屑病**患者。该产品是公司在自身免疫疾病领域上市的**创新药,也是****获批的本土自主研发重组抗IL-17A人源化单克隆抗体,将打破同类进口**的长期垄断局面,为银屑病患者提供新的**选择。至此,恒瑞医药获批上市的创新药达17款。
银屑病是一种自身免疫性皮肤病,目前无法**,其负面影响程度与疾病严重程度密切相关。据统计,我国银屑病患者约700多万,其中中重度银屑病患者占比高达57.3%,估算有近400万人1-3。目前临床亟需皮损**率高、起效快、疗效**且安全性高的**新手段。
生物制剂靶向IL-17A**银屑病,在理论上能够快速起效的机制优势,已得到大量临床数据的充分证实4-6。夫那奇珠单抗是人源化抗体,具有0.8%鼠源成分,保留了来自鼠源的6个CDR区,同时具有“创新结合表位”,从而保证了对IL-17A的高亲和力,能实现与IL-17A精准结合,**靶向阻断IL-17A通路;同时较低的鼠源成分,也**了潜在的免疫原性7。
此次夫那奇珠单抗获批上市是基于一项在**开展的多**、随机、双盲、平行、安慰剂对照的临床 III 期研究(SHR-1314-3018,研究表明,与安慰剂相比,夫那奇珠单抗对中重度斑块状银屑病具有统计学显著性和临床意义的改善。同时,夫那奇珠单抗在中重度慢性斑块状银屑病患者中长期**的安全性、耐受性良好。
作为创新型**化制药企业,恒瑞医药多年来持续围绕临床急需进行创新研发,累计研发投入超400亿元,已在**获批上市17款创新药、4款2类新药,另有90多个自主创新产品正在临床开发,300余项临床试验在**外开展。
除了深耕传统优势的肿瘤领域,公司还积极开辟新赛道,在代谢性疾病、自身免疫疾病、呼吸系统疾病、神经系统疾病、心血管疾病、感染疾病、血液疾病、疼痛管理、眼科等多个领域进行广泛布局。在自身免疫领域,经过多年的沉淀和布局,公司已有10余款产品在研。除中重度斑块状银屑病外,夫那奇珠单抗目前还开展了银屑病关节炎、**活动性强直性脊柱炎等临床研究,其中**活动性强直性脊柱炎已进入上市申报阶段。
未来,恒瑞医药将继续立足民生需求,争分夺秒推进创新药研发,努力研制出更多的新药好药,服务健康**,惠及全球患者。
关于SHR-1314-301
SHR-1314-301研究是一项在**开展的多**、随机、双盲、平行、安慰剂对照的临床III期研究,旨在对夫那奇珠单抗的有效性和安全性进行评估,共纳入690例**中重度斑块状银屑病患者,随机按2:1分成夫那奇珠单抗组(240mg Q2W*3 240mg Q4W和安慰剂组(12周时转为夫那奇珠单抗240mg**,每2周一次,即**2周、14周和16周连续3次给药,之后每4周给药一次8。主要研究终点为12周PASI 90的受试者比例以及**2周达到静态医师**评估(sPGA0/1的受试者比例(sPGA 0/1应答被定义为sPGA评分为0[**]或1[几乎**]。关键次要研究终点包括**2周PASI 75/PASI 100的受试者比例、sPGA 0的受试者比例等。研究结果显示:
夫那奇珠单抗****率高
夫那奇珠单抗组**2周PASI 75应答率达93.6%;PASI 90应答率为76.8%(图1,PASI 90应答中位时间仅8.3周(95%CI, 8.1-8.3周,sPGA 0/1应答率为71.8%(图2,均显著高于安慰剂组。在皮损****方面,夫那奇珠单抗也展现了突出的优势,**2周PASI 100应答率达到36.6%,sPGA 0应答率为38.2%,同样都显著高于安慰剂组。
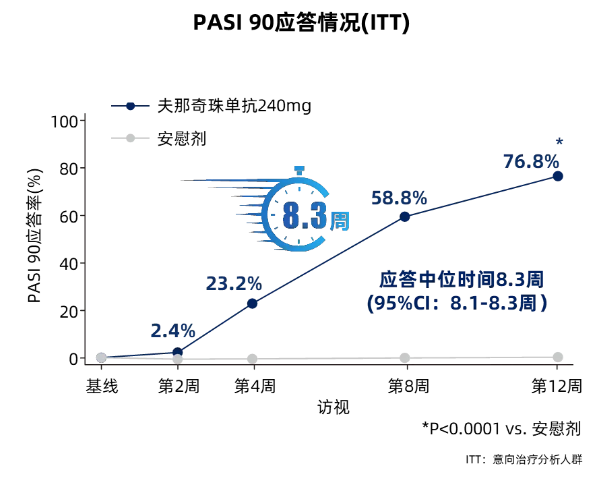
图1 核心期各次访视PASI 90应答情况趋势图
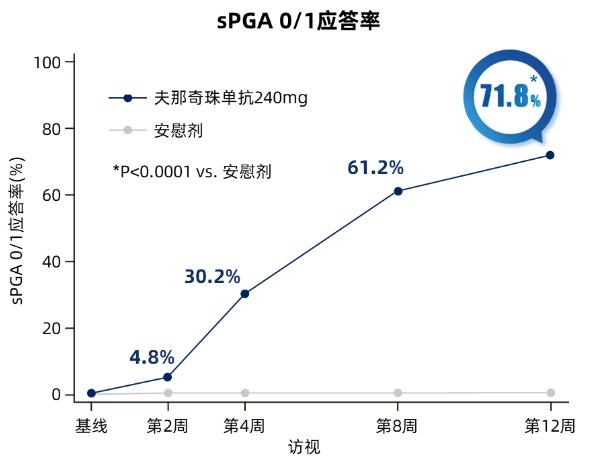
图2 核心期各次访视sPGA 0/1应答情况趋势图
第52周,夫那奇珠单抗组PASI 100应答率达到63.1%(图3,sPGA 0应答率为63.3%(图4,转换组分别为61.1%和60.6%。
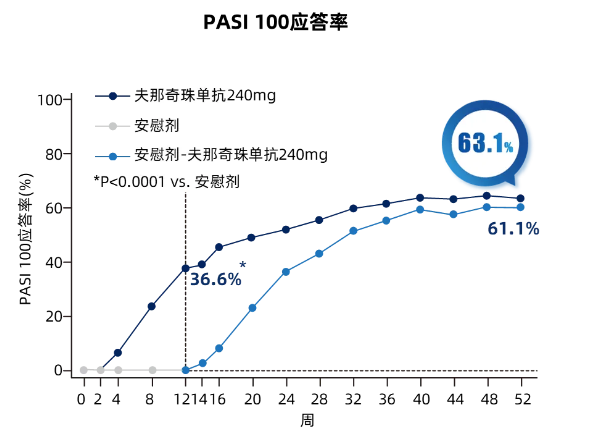
图3 **期(核心期 维持期各次访视PASI 100 应答情况趋势图
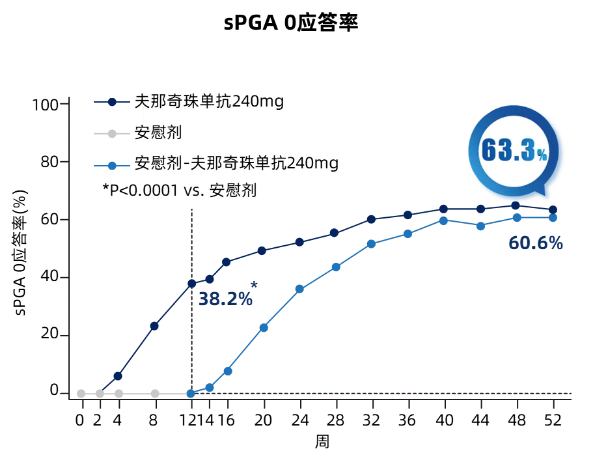
图4 **期(核心期 维持期各次访视sPGA 0 应答情况趋势图
夫那奇珠单抗皮损**起效快
夫那奇珠单抗组在12周内PASI评分较基线变化随时间推移呈明显下降趋势,PASI评分较基线的下降百分比均值在第2周时已达50%以上。根据Kaplan-Meier法估算,夫那奇珠单抗组核心期达到PASI 75的应答中位时间仅4.3周(95%CI, 4.1-4.4周,安慰剂组未达。总体来看,**2周之后,夫那奇珠单抗组PASI评分较基线的百分比均值下降趋于平缓,第28-52周均可维持在97%以上。
·夫那奇珠单抗可提高患者**依从性
安全性方面,夫那奇珠单抗组核心期不良事件发生率与安慰剂组相似,且感染发生率低,无受试者因为注射部位反应而停止**或终止研究。此外,夫那奇珠单抗密集期仅需注射3次,全年注射14次9,注射便捷性高。
本文地址:https://www.bestwheel.com.cn/article/547012.html
文章标题:恒瑞首个自免创新药夫那奇珠单抗获批上市,用于银屑病治疗
版权声明:本文内容由互联网用户自发贡献,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。






